ՀԱՅԱՍՏԱՆԻ ՀԱՆՐԱՊԵՏՈՒԹՅԱՆ ԿՐԹՈՒԹՅԱՆ ԵՎ ԳԻՏՈՒԹՅԱՆ ՆԱԽԱՐԱՐՈՒԹՅՈՒՆ
ՀԱՅԱՍՏԱՆԻ ՊԵՏԱԿԱՆ ՃԱՐՏԱՐԱԳԻՏԱԿԱՆ ՀԱՄԱԼՍԱՐԱՆ
Քիմիական տեխնոլոգիաների
և բնապահպանության
ճարտարագիտության
դեպարտամենտ
Տեսական քիմիայի ամբիոն
ՖՐԻԴՐԻԽ ԳՐԻԳՈՐՅԱՆ
ԱՐՄԵՆ ԳՐԻԳՈՐՅԱՆ
ՌԵԱԿՑԻԱՆԵՐԻ ԸՆԹԱՆԱԼՈՒ ՀԻՄՆԱԿԱՆ ՕՐԻՆԱՉԱՓՈՒԹՅՈՒՆՆԵՐԸ
Ուսումնական ձեռնարկ
ԵՐԵՎԱՆ 2008
ՀՏԴ
Ռեակցիաների ընթանալու հիմնական օրինաչափությունները:
Ուսումնական ձեռնարկ: Ֆ.Գրիգորյան, Ա.Գրիգորյան: Հայաստանի պետական ճարտարագիտական համալսարան£ Երևան, 2008 թ., 49 էջ:
Ներկայացված է Քիմիա-տեխնոլոգիական և բնապահպանական ճարտարագիտություն մասնագիտության ուսանողների, մագիստրանտների և ասպիրանտների համար:
Գրախոս՝ Հ.Մխիթարյան
Ռ.Միրզախանյան
Խմբագիր` Ն Խաչատրյան
Բովանդակություն
ՔԻՄԻԱԿԱՆ ՊՐՈՑԵՍՆԵՐԻ ԹԵՐՄՈԴԻՆԱՄԻԿԱԿՆ ՀԻՄՈՒՆՔՆԵՐԸ
1.2. ԹԵՐՄՈԴԻՆԱՄԻԿԱՅԻ ԱՌԱՋԻՆ ՕՐԵՆՔԸ (ԷՆԵՐԳԻԱՅԻ ՊԱՀՊԱՆՄԱՆ ՕՐԵՆՔԸ)
1.4. ԻԶՈԽՈՐ և ԻԶՈԲԱՐ ՊՐՈՑԵՍՆԵՐԻ ՋԵՐՄՈՒԹՅՈՒՆԸ
1.5. ՌԵԱԿՑԻԱՅԻ ՋԵՐՄԱՅԻՆ ԷՖԵԿՏԸ
1.6. ՋԵՐՄԱՔԻՄԻԱԿԱՆ ՀԱՎԱՍԱՐՈՒՄՆԵՐ
1.8. ՀԵՏԵՎՈՒԹՅՈՒՆՆԵՐ ՀԵՍՍԻ ՕՐԵՆՔԻՑ
1.9. ՌԵԱԿՑԻԱՅԻ ՈՒՂՂՈՒԹՅՈՒՆԸ ՈՐՈՇՈՂ ԳՈՐԾՈՆՆԵՐԸ
1.10. ԷՆՏՐՈՊԻԱ ԵՎ ԱՆԿԱՆՈՆՈՒԹՅՈՒՆ
1.11. ԷՆՏՐՈՊԻԱՅԻ ՎԻՃԱԿԱԳՐԱԿԱՆ ԵՎ ՋԵՐՄԱՅԻՆ ՄԵԿՆԱԲԱՆՈՒԹՅՈՒՆԸ
1.12. ԷՆՏՐՈՊԻԱՅԻ ՓՈՓՈԽՈՒԹՅՈՒՆԸ ՈՐՈՇ ՊՐՈՑԵՍՆԵՐՈՒՄ
1.13. ԳԻԲՍԻ ԱԶԱՏ ԷՆԵՐԳԻԱՆ ՈՐՊԵՍ ՊՐՈՑԵՍԻ ՈՒՂՂՈՒԹՅԱՆ ԸՆԴՀԱՆՈՒՐ ՉԱՓԱՆԻՇ
1.14. ԳՈՅԱՑՄԱՆ ԳԻԲՍԻ ՍՏԱՆԴԱՐՏ ԷՆԵՐԳԻԱ
2. ՔԻՄԻԱԿԱՆ ԿԻՆԵՏԻԿԱ ԵՎ ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅՈՒՆ
2.1. ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅՈՒՆ
2.2. ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅԱՆ ԿԱԽՈՒՄԸ ՌԵԱԿՑՈՂ ՆՅՈՒԹԵՐԻ ԿՈՆՑԵՆՏՐԱՑԻԱՅԻՑ
2.3. ՌԵԱԿՑԻԱՅԻ ՄՈԼԵԿՈՒԼԱՅՆՈՒԹՅՈՒՆԸ ԵՎ ԿԱՐԳԸ
2.4. ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅԱՆ ԿԱԽՈՒՄԸ ՋԵՐՄԱՍՏԻՃԱՆԻՑ
2.5. ԿԱՏԱԼԻԶ: ՀԻՄՆԱԿԱՆ ՀԱՍԿԱՑՈՒԹՅՈՒՆՆԵՐ
2.6. ԿԱՏԱԼԻԶԻ ՏԵՍՈՒԹՅԱՆ ՏԱՐՐԵՐԸ
2.8. ՔԻՄԻԱԿԱՆ ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅՈՒՆ
2.9. ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅԱՆ ՏԵՂԱՇԱՐԺ
1. ՔԻՄԻԱԿԱՆ ՊՐՈՑԵՍՆԵՐԻ ԹԵՐՄՈԴԻՆԱՄԻԿԱԿԱՆ ՀԻՄՈՒՆՔՆԵՐԸ
1.1. ՆԵՐԱԾՈՒԹՅՈՒՆ
Քիմիական ռեակցիաների էներգետիկ էֆեկտների տվյալները լայնորեն կիրառվում են մոլեկուլների ռեակցիոն ունակությունը, կապի էներգիան, նյութի կառույցը պարզաբանելու համար: Այդ պատճառով անհրաժեշտ է դիտարկել քիմիական պրոցեսների էներգետիկ բնութագրերը:
Քիմիայի այն բաժինը, որն ուսումնասիրում է քիմիական ռեակցիայի ժամանակ անջատված կամ կլանված ջերմությունը և դրա վրա ազդող գործոնները, կոչվում է ջերմաքիմիա:
Ջերմաքիմիայի տեսական հիմքը քիմիական թերմոդինամիկան է: Քիմիական թերմոդինամիկայի ուսումնասիրման օբյեկտը համակարգն է: Համակարգը շրջապատի իրական կամ երևակայական սահմաններով բաժանված մակրոսկոպիկ մասն է: Օրինակ` սենյակը կամ սենյակի կեսը:
Համակարգը, որը շրջապատի հետ ունի էներգափոխանակություն, բայց չունի նյութափոխանակություն կոչվում է փակ:
Համակարգը, որը շրջապատի հետ ունի և´ էներգափոխանակություն և´ նյութափոխանակություն կոչվում է բաց:
Համակարգը, որը շրջապատի հետ չունի էներգափոխանակություն և նյութափոխանակություն կոչվում է մեկուսացված:
Համակարգի վիճակը բնորոշող մեծությունները կոչվում են վիճակի ֆունկցիաներ: Օրինակ, ջերմաստիճանը` T, ճնշումը` P, կոնցենտրացիան` C և այլն:
Վիճակի ֆունկցիաների փոփոխությունը կախված է միայն սկզբնական և վերջնական վիճակներից և կախված չէ միջանկյալ փուլերից:
Թերմոդինամիկայում քննարկվում են միայն այնպիսի վիճակներ, որոնց դեպքում վիճակի ֆունկցիաները չեն փոխվում ժամանակի ընթացքում: Այդպիսի վիճակները կոչվում են հավասարակշռային վիճակներ:
Այսպիսով, քիմիական թերմոդինամիկ քիմիայի բաժինն է, որն ուսումնասիրում է.
1. էներգիայի անցումը մի ձևից մի այլ ձևի, համակարգի մի մասից մյուս մասը,
2. քիմիական և ֆիզիկական երևույթներին ուղեկցող էներգետիկ էֆեկտները,
3. պրոցեսի ինքնաբերաբար ընթանալու հնարավորությունը և ուղղությունը:
1.2. ԹԵՐՄՈԴԻՆԱՄԻԿԱՅԻ ԱՌԱՋԻՆ ՕՐԵՆՔԸ
(ԷՆԵՐԳԻԱՅԻ ՊԱՀՊԱՆՄԱՆ ՕՐԵՆՔԸ)
Համակարգին հաղորդված Q ջերմությունը ծախսվում է ներքին էներգիայի փոփոխության ΔU և արտաքին ուժերի դեմ կատարվող A աշխատանքի վրա
![]()
U ներքին էներգիա ասելով հասկանում ենք համակարգի մեջ մտնող բոլոր մասնիկների կինետիկ և պոտենցիալ էներգիաները: Պոտենցիալ էներգիայի մեջ մտնում է ատոմների միջուկի էներգիան, միջուկների և էլեկտրոնների փոխազդեցության էներգիան, մոլեկուլների փոխազդեցության էներգիան: Կինետիկ էներգիայի մեջ մտնում են մոլեկուլների պտտման և տատանողական էներգիան, նաև մոլեկուլների քաոսային շարժման էներգիան: Այդ էներգիայի մեջ չի մտնում ամբողջությամբ վերցրած համակարգի պոտենցիալ և կինետիկ էներգիան:
1.3.ԱՇԽԱՏԱՆՔ ԵՎ ՋԵՐՄՈՒԹՅՈՒՆ
Աշխատանքը և ջերմությունը վիճակի ֆունկցիաներ չեն:
Ջերմությունը մի մարմնից մյուս մարմնին հաղորդած էներգիան է մոլեկուլների քաոսային շարժման միջոցով:
Աշխատանքը մի մարմնից մյուս մարմնին հաղորդած էներգիան է մոլեկուլների ուղղորդված շարժման միջոցով.
![]()
որտեղ P -ն ճնշումն է,
ΔV-ն ծավալի փոփոխությունը,
PΔV-ն ծավալի փոփոխության աշխատանքը
A'-ը մնացած աշխատանքները:
1.4. ԻԶՈԽՈՐ և ԻԶՈԲԱՐ ՊՐՈՑԵՍՆԵՐԻ ՋԵՐՄՈՒԹՅՈՒՆԸ
Ռեակցիաները սովորաբար ընթանում են կամ փակ անոթում` V = const, ΔV = 0, այսինքն` ծավալը մնում է հաստատուն, կամ բաց անոթում` P = const, այսինքն` ճնշումը մնում է հաստատուն:
1.Իզոխոր-իզոթերմ պրոցեսների ջերմություն:
Իզոխոր-իզոթերմ կոչվում է այն պրոցեսը, որն ընթանում է հաստատուն ծավալում V = const, ΔV = 0 և հաստատուն ջերմաստիճանում` T = const:

Այսպիսով, իզոխոր-իզոթերմ պրոցեսի ջերմությունը հավասար է ներքին էներգիայի փոփոխությանը:
2.Իզոբար-իզոթերմ կոչվում է այն պրոցեսը, որն ընթանում է հաստատուն ճնշման P = const և հաստատուն ջերմաստիճանի պայմաններում (բաց անոթ):
![]()
Ներքին էներգիայի և նյութի ծավալի ճնշման արտադրյալի գումարը կոչվում է էնթալպիա (ջերմապարունակություն) և նշանակվում է H տառով, ուստի.

Էնթալպիան, ճնշմանը, ջերմաստիճանին, ծավալին և ներքին էներգիային համանման համակարգի վիճակի ֆունկցիա է:
Այսպիսով, իզոբար-իզոթերմ պրոցեսի ջերմությունը հավասար է համակարգի էնթալպիայի փոփոխությանը.
![]()
Քիմիական ռեակցիաների ընթանալու ժամանակ ելանյութի մոլեկուլներում եղած կապերը խզվում են, որի համար ծախսվում է որոշակի էներգիա, և առաջանում են նոր կապեր վերջնանյութերի մոլեկուլներում, որի արդյունքում անջատվում է էներգիա: Ընդհանուր դեպքում, այդ անջատված և կլանված էներգիաները իրար հավասար չեն, ուստի ռեակցիաներն ուղեկցվում են էներգիայի անջատումով կամ կլանումով, կախված նրանից, թե այդ էներգիաներից որն է ավելի մեծ: Էներգիայի այդ էֆեկտը ռեակցիաների մեծ մասի դեպքում իրականանում է ջերմային էներգիայի ձևով:
1.5.ՌԵԱԿՑԻԱՅԻ ՋԵՐՄԱՅԻՆ ԷՖԵԿՏԸ
Քիմիական ռեակցիայի ջերմային էֆեկտ ասելով հասկանում ենք ռեակցիայի ժամանակ անջատված կամ կլանված ջերմությունը հաստատուն ջերմաստիճանի և ճնշման կամ հաստատուն ջերմաստիճանի և ծավալի պայմաններում: Այլ խոսքով ռեակցիայի ջերմային էֆեկտը էնթալպիայի (QP,T) կամ ներքին էներգիայի (QV,T) փոփոխությունն է ռեակցիայի ընթացքում:
Համարյա բոլոր պրոցեսներն ընթանում են հաստատուն ծավալում, այսինքն` փակ անոթում, կամ հաստատուն ճնշման տակ, այսինքն բաց անոթում: Քիմիական պրոցեսների ճնշող մեծամասնությունն ընթանում է հաստատուն ճնշման տակ P = const: Իզոբար ռեժիմը (որպես կանոն P = 101 կՊա) բնորոշ է լաբորատոր և արտադրական պրոցեսներին: Այդ պատճառով սովորաբար դիտարկվում է ջերմային էֆեկտը P,T = const պայմաններում, այսինքն էնթալպիայի փոփոխությունը` ΔH :
Այսպիսով իզոբար պրոցեսի համար ունենք.
![]()
Իզոխոր պրոցեսի ջերմությունը հավասար է.
![]()
Բերված հավասարումներից երևում է, որ QP ≠ QV , այսինքն` ռեակցիայի ջերմային էֆեկտը կախված է ընթանալու պայմաններից:
Քիմիական ռեակցիաներն ընթանում են ջերմության անջատումով, կամ կլանումով:
Այն ռեակցիաները, որոնց ընթացքում ջերմությունն անջատվում է կոչվում են ջերմանջատիչ (էկզոթերմ) ռեակցիաներ: Իսկ այն ռեակցիաները, որոնց ընթացքում ջերմությունը կլանվում է կոչվում են ջերմակլանիչ (էնդոթերմ) ռեակցիաներ (նկ.1.1):
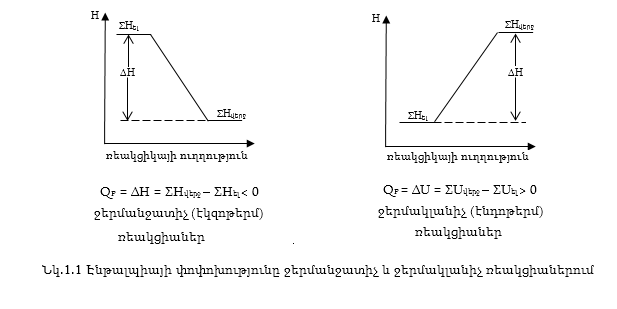
1.6. ՋԵՐՄԱՔԻՄԻԱԿԱՆ ՀԱՎԱՍԱՐՈՒՄՆԵՐ
Քիմիական հավասարումները, որոնցում նշված է ռեակցիայի ջերմային էֆեկտը հաստատուն ճնշման և ջերմաստիճանի պայմաններում (պրոցեսի ΔH կամ ΔU), կոչվում են ջերմաքիմիական հավասարումներ: Ջերմաքիմիական հավասարումները տարբերվում են սովորական քիմիական հավասարումներից երեք հատկանիշներով.
1) հավասարումից հետո գրվում է ջերմային էֆեկտը` ΔH (կՋ/մոլ)
2) հավասարման գործակիցները ցույց են տալիս ոչ թե մոլեկուլների, այլ մոլերի թիվը, որի պատճառով նա կարող է լինել նաև կոտորակային թիվ
3) նյութերի բանաձևերի աջ մասում նշվում է նյութի վիճակը` (բ)- բյուրեղային, (հ)- հեղուկ, (գ)- գազային, (լ)- լուծույթ.
![]()
Հավասարումը ցույց է տալիս, որ 1մոլ գազային H2-ից 0.5 մոլ գազային O2-ից առաջանում է մեկ մոլ հեղուկ ջուր և անջատվում է 285.5 կՋ ջերմություն: Մինուս նշանը ցույց է տալիս, որ ջերմությունն անջատվել է: Եթե հատուկ չի նշված, ապա ΔH-ի արժեքը բերված է ստանդարտ ջերմաստիճանի t = 250C (T = 298 K) և ստանդարտ ճնշման 101 կՊա (1մթն) պայմաններում:
Ջերմային էֆեկտը չափելու համար օգտագործում են կալորիմետրեր: Եթե կալորիմետրի և շրջապատի միջև չկա ջերմափոխանակություն (կալորիմետրը մեկուսացված է), ապա
![]()
որտեղ C-ն կալորիմետրի և ուսումնասիրվող նյութի ջերմունակությունն է, այսինքն` ջերմության այն քանակը, որը պետք է հաղորդել կալորիմետրին և ուսումնասիրվող նյութին` ջերմաստիճանը մեկ աստիճանով փոփոխելու համար, Δ T-ն ջերմաստիճանի փոփոխությունն է:
1.7. ՋԵՐՄԱՔԻՄԻԱՅԻ ՕՐԵՆՔՆԵՐԸ
Ջերմաքիմիայի հիմնական օրենքը Հեսսի օրենքն է:
Ռեակցիայի ջերմային էֆեկտը կախված չէ միջանկյալ փուլերից, այլ կախված է սկզբնական և վերջնական նյութերի տեսակից և դրանց վիճակից: Այլ խոսքով, մի շարք իրար հաջորդող ռեակցիաների ջերմային էֆեկտների գումարը հավասար է մի այլ շարք ռեակցիաների ջերմային էֆեկտների գումարին, եթե ելանյութերը և վերջնանյութերը նույնն են և գտնվում են միևնույն վիճակում: Հեսսի օրենքը ճշմարիտ է կամ հաստատուն ծավալի (V = const), կամ հաստատուն ճնշման (P = const) պայմաններում: Ենթադրվում է նաև, որ ելանյութերի և վերջնանյութերի ջերմաստիճանը միևնույնն է (T = const), և համակարգում ոչ մի աշխատանք չի կատարվում, բացի արտաքին ճնշման դեմ, այսինքն` ծավալի փոփոխման հետ կապված աշխատանքից:
Քանի որ ռեակցիայի ջերմային էֆեկտը վիճակի ֆունկցիա է և հաստատուն ճնշման դեպքում հավասար է էնթալպիայի փոփոխությանը, ապա այդ փոփոխությունը հավասար է.
![]()
Ածխածնից կարելի է ստանալ CO2 երկու ճանապարհով:
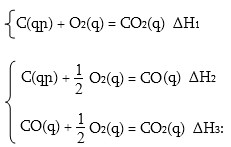
Ըստ Հեսսի օրենքի` CO2 առաջացման ջերմային էֆեկտը ինչպես պարզ նյութերից, այնպես էլ միջանկյալ փուլով CO-ի առաջացումով հավասար են.
![]()
Իմանալով այս մեծություններից երկուսը, կարելի է հաշվել երրորդը` CO2 առաջացման ջերմային էֆեկտը (ΔH1), իսկ CO-ի այրման ջերմային էֆեկտը (ΔH3) որոշվում է փորձնականորեն: Սակայն CO-ի առաջացման ջերմային էֆեկտը (ΔH2) հնարավոր չէ չափել, քանի որ հնարավոր չէ այնպես իրականացնել ածխածնի այրումը, որ ստացվի միայն CO, ուստի կարելի է հաշվել` ունենալով ΔH1 = 396 կՋ և ΔH3 = –285.5կՋ:
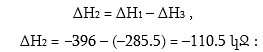
1.8. ՀԵՏԵՎՈՒԹՅՈՒՆՆԵՐ ՀԵՍՍԻ ՕՐԵՆՔԻՑ
Հեսսի օրենքից, որը թերմոդինամիկայի առաջին օրենքի հետևանքն է, բխում են մի շարք հետևություններ, որոնցից առավել կարևոր նշանակություն ունեն երկուսը:
1. Ռեակցիայի ջերմային էֆեկտը հավասար է վերջանյութերի գոյացման ջերմությունների գումարի և ելանյութերի գոյացման ջերմությունների գումարի տարբերությունը:
Գոյացման ջերմությունը ջերմության այն քանակն է, որն անջատվում կամ կլանվում է պարզ նյութերից մեկ մոլ բարդ նյութ ստանալիս: Այն չափվում է կՋ/մոլ մեծությամբ:
Ստանդարտ
պայմաններում
չափված
գոյացման
ջերմությունը
կոչվում
է ստանդարտ
գոյացման
ջերմություն![]() : Ստանդարտ
պայմաններն
են T = 298 K, P
= 101 կՊա:
Ստանդարտ
պայմաններում
կայուն
պարզ
նյութերի
(գրաֆիտ,
ֆոսֆոր,
ծծումբ)
գոյացման
ջերմությունները
հավասար
են զրոյի:
: Ստանդարտ
պայմաններն
են T = 298 K, P
= 101 կՊա:
Ստանդարտ
պայմաններում
կայուն
պարզ
նյութերի
(գրաֆիտ,
ֆոսֆոր,
ծծումբ)
գոյացման
ջերմությունները
հավասար
են զրոյի:
![]()
ռեակցիայի համար ΔH ջերմային էֆեկտը հավասար է
![]()
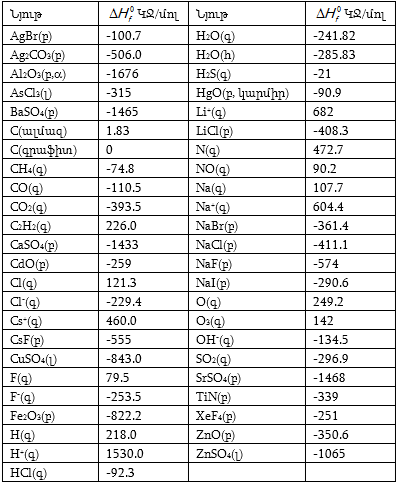
Օրինակ 1.1. Հաշել Al2O3(բ) + 3SO3(գ) = Al2(SO4) 3 (բ) ռեակցիայի ջերմային էֆեկտը, եթե
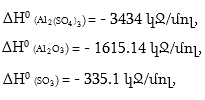
Լուծում. ΔH-ը որոշվում է հետևյալ հավասարումով.
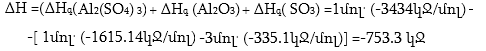
2.Ռեակցիայի ջերմային էֆեկտը հավասար է ելանյութերի այրման ջերմության![]() և
վերջնանյութի այրման ջերմության տարբերությանը
և
վերջնանյութի այրման ջերմության տարբերությանը ![]() :
:
Տվյալ նյութի այրման ջերմություն ասելով հասկանում ենք 1 մոլ նյութի այրման ջերմային էֆեկտը: Այրման վերջնանյութերի, այսինքն չայրվող նյութերի (H2O, CO2) այրման ջերմությունը հավասար է զրոյի:
Գոյացման և այրման ջերմությունների մեծությունն օգտագործելով` կարելի է հաշվարկել զանազան պրոցեսների էներգետիկ էֆեկտները:
Օրինակ 1.2. Հաշվել FeCl3–ի լուծման պրոցեսի ջերմային էֆեկտը, եթե ստանդարտ գոյացման ջերմությունները`
![]()
Լուծում .
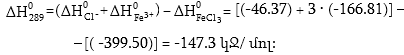
բ) Ֆազային փոխարկման պրոցեսի համար
Օրինակ 1.3 Հաշվել Na(բ) Na(լ) պրոցեսի ջերմային էֆեկտը, եթե
![]()
Լուծում.
![]()
գ) Երկատոմ մոլեկուլների դիսոցման համար (քիմիական կապի էներգիան)
![]()
Օրինակ 1.4 Հաշվել Cl2(գ) 2Cl(գ) պրոցեսի ջերմային էֆեկտը, եթե
![]()
Լուծում .
![]()
դ) Իոնացման էներգիայի որոշման համար:
Օրինակ 1.5 Հաշվել H(գ) H+(գ) + e- պրոցեսի ջերմային էֆեկտը (իոնացման էներգիան), եթե
![]()
Լուծում .
![]()
1.9. ՌԵԱԿՑԻԱՅԻ ՈՒՂՂՈՒԹՅՈՒՆԸ ՈՐՈՇՈՂ ԳՈՐԾՈՆՆԵՐԸ
Մեխանիկական համակարգերում պրոցեսն ինքնաբերաբար ընթանում է էներգիայի նվազման կողմը: Գնդիկը ինքնաբերաբար ավելի բարձր կետից գլորվում է ավելի ցածր կետը, սակայն ավելի ցածր կետից ավելի բարձր կետ տեղափոխվելու համար անհրաժեշտ է ծախսել էներգիա (նկ. 1.1):
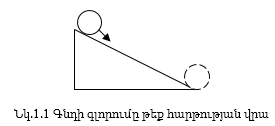
Կարելի է կարծել, որ այս սկզբունքը տարածվում է բոլոր պրոցեսների, այդ թվում` քիմիական ռեակցիաների վրա, այսինքն` քիմիական ռեակցիաները ինքնաբերաբար ընթանում են միայն ներքին էներգիայի նվազման` էկզոթերմիկ ռեակցիայի ուղղությամբ:
Սակայն քիմիական պրոցեսների ուղղությունը միայն ներքին էներգիայի նվազագույնին ձգտելու հատկությամբ բացատրելը հակասում է փաստերին: Հայտնի են բազմաթիվ ինքնաբերաբար ընթացող ջերմակլանիչ ռեակցիաներ, որոնց դեպքում ներքին էներգիան աճում է, օրինակ` կերակրի աղի լուծումը ջրում: Միաժամանակ շատ պրոցեսներ ինքնաբերաբար չեն ընթանում, չնայած որ, եթե ընթանային, կլինեին ջերմանջատիչ, օրինակ` գազերի մոլեկուլները մթնոլորտում մնում են կախված, բայց չեն իջնում երկրի երես:
1.10. ԷՆՏՐՈՊԻԱ ԵՎ ԱՆԿԱՆՈՆՈՒԹՅՈՒՆ
Վերցնենք երկու անոթ` միացված փականով: Ձախ անոթը լցված է օդով, իսկ աջից հանված է օդը:
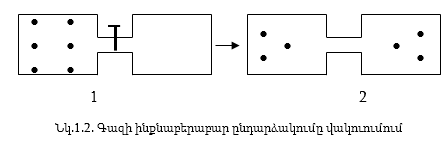
Եթե բացենք փականը, օդը ձախ անոթից ինքնաբերաբար կլցվի աջ անոթը և հավասարաչափ կբաշխվի երկու անոթներում: Գազի ինքնաբերաբար սեղմում տեղի չի ունենա: Գազի էներգիան չի փոխվի, որովհետև աշխատանք չի կատարվել: Առաջին վիճակը ավելի կանոնավոր է, քան երկրորդը:
Համակարգը ինքնաբերաբար ավելի կանոնավոր վիճակից անցնում է ավելի անկանոն վիճակի: Այսպիսով, պրոցեսի ուղղությունը որոշվում է ոչ միայն ներքին էներգիայի նվազումով, այլ նաև համակարգի անկանո-նության աճով: Մտցնենք մի նոր անկանոնություն բնորոշող վիճակի ֆունցիա, և անվանենք էնտրոպիա և նշանակենք S տառով:
1.11. ԷՆՏՐՈՊԻԱՅԻ ՎԻՃԱԿԱԳՐԱԿԱՆ ԵՎ ՋԵՐՄԱՅԻՆ ՄԵԿՆԱԲԱՆՈՒԹՅՈՒՆԸ
Տվյալ համակարգի անկանոնությունը բնորոշվում է թերոդինամիկական հավանականությամբ` W: Թերմոդինամիկական հավանականությունը տարբերվում է մաթեմատիկական հավանականությունից նրանով, որ այն մեծ է մեկից:
Թերմոդինամիկական հավանականությունը ցույց է տալիս տվյալ մակրովիճակը բնորոշող միկրովիճակների թիվը (W):
Ցանկացած մասնիկների ամբողջության վիճակը բնորոշվում է երկակի.
1.Նշել նյութի չափվող հատկությունների մեծությունները, ինչպիսին են ճնշումը, ջերմաստիճանը, այդ բնութագիրը, նրա մակրովիճակն է:
2.Նշել յուրաքանչյուր մասնիկի ակնթարթային բնութագրերը, նրա տեղը տարածության մեջ, արագությունը և տեղաշարժի ուղղությունը - այդ բնութագիրը նյութի միկրովիճակն է: Քանի որ մարմինը կազմված է հսկայական թվով մասնիկներից, ապա տվյալ միկրովիճակին համապատասխանում են հսկայական թվով տարբեր միկրովիճակներ:
Նորից քննարկենք գազի ընդարձակման փորձը ոչ մեծ թվով մոլեկուլներ պարունակող համակարգում:
Ենթադրենք անոթում գտնվում են երկու մոլեկուլ, որոնց նշանակենք 1 և 2:
Մոլեկուլների հավասարաչափ բաշխումը երկու անոթներում, որին համապատասխանում է որոշակի մակրովիճակ կարող է իրականանալ երկու միկրովիճակներում:
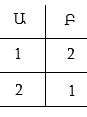
Այն միկրովիճակը, որի դեպքում մոլեկուլները գտնվում են անոթի մի մասում (օրինակ Ա մասում), իրականանում է միակ միկրովիճակով:
Տվյալ դեպքում մոլեկուլների հավասարաչափ բաշխումը երկու անգամ ավելի հավանական է, քան նրանց անցումը Ա կամ Բ մասերում:
Համակարգի այս կամ այն մակրովիճակը այնքան ավելի հավանական է, որքան ավելի մեծ թվով միկրովիճակներով կարող է իրականացվել այն:
Այժմ ենթադրենք, թե անոթում կա չորս մոլեկուլ, որոնք կրկին համարակալենք: Դրանց բաշխումը անոթի Ա կամ Բ մասերում կարող է իրականացվել վեց միկրովիճակներով:

Մասնիկների քանակի ավելացման հետ n-թվով մոլեկուլների դեպքում անկանոն վիճակի իրականացման հնարավորությունը մեծանում է, իսկ կարգավորված բաշխման, այսինքն անոթի մեկ կողմում գտնվելու հավանականությունը դառնում է զրո: Հետևաբար համակարգի առավել հավանական վիճակը նրա առավել անկարգավորված վիճակն է: Էնտրոպիայի և թերմոդինամիկական հավանականության (W) միջև կա հետևյալ կապը`
![]()
որտեղ R-ը մոլային գազային հաստատունն է,
NA-ն Ավոգադրոյի թիվը,
S-ը էնտրոպիան,
K-ն Բոլցմանի հաստատունն է:
Էնտրոպիայի փոփոխությունը հավասար է.
![]()
Ըստ թերմոդինամիկայի երկրորդ օրենքի մեկուսացված համակարգում պրոցեսն ինքնաբերաբար ընթանում է էնտրոպիայի մեծացման, այսինքն` անկանոնության մեծացման կողմը.
![]()
Եթե պրոցեսը տարվում է հակադարձելիորեն և հաստատուն ջերմաստիճանում, ապա էնտրոպիայի փոփոխությունը կապված է կլանված կամ անջատված ջերմության հետ:
![]()
որտեղ Q-ն կլանված կամ անջատված ջերմությունն է, T-ն բացարձակ ջերմաստիճանը:
1.12. ԷՆՏՐՈՊԻԱՅԻ ՓՈՓՈԽՈՒԹՅՈՒՆԸ ՈՐՈՇ ՊՐՈՑԵՍՆԵՐՈՒՄ
Որպես օրինակ քննարկենք բյուրեղային կապարի հալումը: Բյուրեղ առաջացնող մասնիկները դասավորված են խիստ որոշակի (բյուրեղային ցանցի հանգույցներում), իսկ հեղուկում դասավորված են ավելի անկանոն Wհ >Wբ: Այդ պատճառով բյուրեղների հալման ժամանակ տեղի ունի էնտրոպիայի մեծացում.
![]()
Այսպիսով, հալման ժամանակ էնտրոպիայի փոփոխությունը դրական է ∆Sհ > 0 համանման գոլորշիացման, այսինքն` հեղուկի գոլորշու անցման ժամանակ Wգ > Wհ, որի պատճառով էնտրոպիայի փոփոխությունը գոլորշագոյացման ժամանակ դրական մեծություն է ∆Sգ > 0:
Քանի որ Wգ-ն ավելի շատ է տարբերվում Wհ-ից, քան Wհ-ն է Wգ-ից, ապա ∆Sգ >> ∆Sհ:
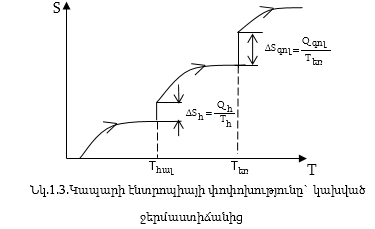
Քիմիական ռեակցիաների ժամանակ էնտրոպիայի փոփոխությունը հաշվում են այնպես, ինչպես անցման ժամանակ հաշվում են էնտրոպիայի փոփոխությունը վերջնական և սկզբնական վիճակների միջև, ինչպես հաշվում են ∆H-ը:
![]()
Օրինակ 1.6. Հաշվել Cգր + CO2(գ) = 2COգ ռեակցիայի էնտրոպիայի փոփոխությունը, եթե
![]()
Լուծում.
![]()
1.13. ԳԻԲՍԻ ԱԶԱՏ ԷՆԵՐԳԻԱՆ ՈՐՊԵՍ ՊՐՈՑԵՍԻ ՈՒՂՂՈՒԹՅԱՆ ԸՆԴՀԱՆՈՒՐ ՉԱՓԱՆԻՇ
Քիմիական պրոցեսների մեծ մասն ուղեկցվում է էնթալպիայի և էնտրապիայի փոփոխությամբ: Նրանք անկախ են իրարից: Ցանկացած համակարգի, այդ թվում և քիմիական ռեակցիաների կայունությունը, որոշվում է էնտրոպիական և էնթալպիական գործոններով: Այդ մեծությունների տարբերությունը կոչվում է Գիբսի ազատ էներգիայի փոփոխություն.
![]()
G ֆունկցիան կոչվում է իզոբար-իզոթերմ պոտենցիալ կամ Գիբսի ազատ էներգիա: Գիբսի էներգիայի փոփոխությամբ կարելի է դատել պրոցեսի ուղղության մասին:
Հաստատուն ճնշման և ջերմաստիճանի պայմաններում պրոցեսն ընթանում է ինքնաբերաբար, եթե ∆G բացասական մեծություն է ∆G < 0:
Այստեղից բխում է, որ պրոցեսը գնում է ինքնաբերաբար, եթե Գիբսի ազատ էներգիան նվազում է: Եթե ∆G>0 պրոցեսը չի ընթանում:
Ցանկացած պրոցես կարելի է դիտարկել երեք դեպքերի համար.
1. ∆S = 0, ∆G = ∆H - T∆S = 0 = ∆H < 0, այսինքն` անկայունությունը անփոփոխ է, ապա պրոցեսը ինքնաբերաբար ընթանում է էներգիայի նվազման կողմը ∆H < 0:
2. ∆H = 0, ∆G = ∆H - T∆S = –T∆S < 0, այսինքն, եթե համակարգի էներգիան անփոփոխ է, ապա պրոցեսն ընթնում է էնտրոպիայի մեծացման, այսինքն անկայունության աճման կողմը ∆S > 0:
Եթե և` էնտրոպիան, և` էնթալպիան փոփոխական են ∆H ≠ 0, ∆S ≠ 0, ապա պրոցեսի ուղղությունը որոշում է Գիբսի ազատ էներգիայի փոփոխությունը: Այսպիսով, ռեակցիայի ինքնաբերաբար ընթանալու ընդհանուր պայմանն է ∆G<0:
Գիբսի էներգիայի փոփոխության բանաձևի վերլուծությունը հնարավորություն է տալիս պարզել պրոցեսների ընթացման հարցերը.
Առաջին դեպք. ենթադրենք ռեակցիան էկզոթերմիկ է, արդյոք դա նշանակում է, որ ռեակցիան անպայման կընթանա: ∆G = ∆H - T∆S բանաձևից երևում է, որ դա կախված է նաև ∆S-ի նշանից և մեծությունից.
1.եթե ∆H < 0 և ∆S > 0, ապա ∆G կլինի փոքր զրոյից և ռեակցիան կընթանա:
2.եթե ∆H < 0 և ∆S < 0, ապա ինթնաբերաբար կընթանա պրոցեսը թե ոչ, կախված կլինի ∆H-ի և T∆S-ի բացարձակ արժեքներից:
![]()
ապա պրոցեսը կընթանա, իսկ եթե
![]()
ապա պրոցեսը չի ընթանա: Վերջին դեպքը վերաբերում է օդում եղած գազերի մոլեկուլների երկրի երեսին չիջնելու դեպքին: Եթե այդ պրոցեսը տեղի ունենար, այն կլիներ ջերմանջատիչ` ∆H < 0, սակայն այդ դեպքում քաոսային շարժման վիճակում գտնվող խիստ անկարգավորված մոլեկուլները երկրի երեսին կանցնեին կարգավորված վիճակի` ∆S << 0:
Ուստի այդ պրոցեսի
![]()
այդ պատճառով նման պրոցեսը տեղի չի ունենա: Այս դեպքում էնտրոպիական գործոնը` T∆S խիստ գերակշռում է էնթալպիականին:
Երկրորդ դեպք. ենթադրենք պրոցեսը էնդոթերմ է ∆H > 0: ∆G-ի բանաձևից երևում է, որ այդ դեպքում`
1. եթե ∆S < 0 , ապա ∆G-ն կլինի մեծ զրոյից և պրոցեսը չի ընթանա:
2. եթե ∆H > 0, ∆S > 0, ապա պրոցեսի ընթանալ-չընթանալը կորոշվի էնթալպիական և էնտրոպիական գործոնների բացարձակ արժեքներով:
ա. ∆H > 0, T∆S > ∆H, ապա ∆G < 0 և պրոցեսը կընթանա: Այս դեպքը վերաբերում է, օրինակ, կերակրի աղի լուծմանը: Այդ պրոցեսը էնդոթերմ է ∆H > 0, սակայն ինքնաբերաբար ընթանում է, այսինքն լուծման հետևանքով բյուրեղներում կանոնավոր դասավորված բյուրեղները լուծույթ են անցնում և անկարգավորված վիճակի էնտրոպիան մեծանում է և T ∆S >> ∆H, այդ պատճառով ∆G < 0:
բ.
եթե ∆H > 0, և T∆S < ∆H,
ապա պրոցեսը չի
ընթանա ∆G > 0:
Սակայն այս
դեպքում, եթե
բարձրացվի
ջերմաստիճանը
T∆S կմեծանա և
ինչ-որ ջերմաստիճանից
սկսած կանցնի
∆H: T∆S > ∆H, և
ռեակցիան կսկսվի:
Այս պատճառով
էնդոթերմ շատ
պրոցեսներ, որոնք
ուղեկցվում
են
էնտրոպիայի
մեծացումով,
ցածր
ջերմաստիճանում
չեն ընթանում,
իսկ
ջերմաստիճանը
բարձրացնելիս
ընթանում են,
օրինակ,
կրաքարը(կավիճը)
ցածր
ջերմաստիճանում
չի
քայքայվում CaCO3
= CaO + CO2, ∆H0, սակայն
քանի որ
ընթացքի
դեպքում գազի
առաջացման
հետևանքով
էնտրոպիան
կմեծանա, ∆S > 0,
ջերմաստիճանի
բարձրացումից
T∆S մեծանում է
և 9030C -ում
անցնում է
∆H-ից: ∆G-ն
փոխում է
նշանը, և ռեակցիան
սկսվում է:
Գիբսի
էներգիայի
հավասարումից
երևում է, որ
եթե ![]() ապա ∆G = 0, այդ
դեպքում
պրոցեսը
կլինի
դարձելի:
ապա ∆G = 0, այդ
դեպքում
պրոցեսը
կլինի
դարձելի:
1.14.ԳՈՅԱՑՄԱՆ ԳԻԲՍԻ ՍՏԱՆԴԱՐՏ ԷՆԵՐԳԻԱ
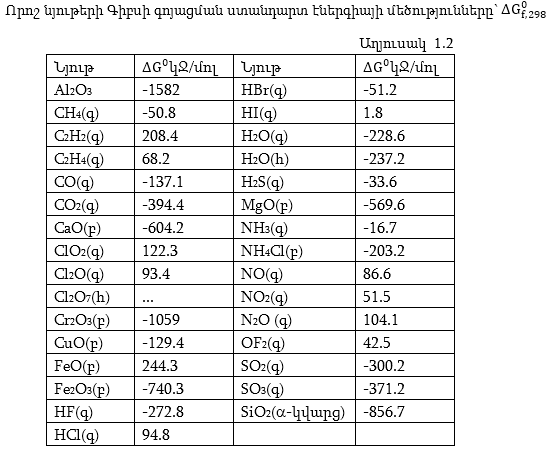
Ստանդարտ պայմաններում պարզ նյութերից մեկ մոլ տվյալ նյութը ստանալու ռեակցիայի Գիբսի էներգիայի փոփոխությունը կոչվում է գոյացման ստանդարտ Գիբսի էներգիա: Այս սահմանումը բխում է նրանից, որ ստանդարտ պայմաններում կայուն պարզ նյութերի գոյացման ստանդարտ Գիբսի էներգիայի փոփոխությունը կախված չէ պրոցեսի ուղուց: Այդ պատճառով յուրաքանչյուր կոնկրետ պրոցեսում Գիբսի ստանդարտ էներգիայի փոփոխությունը հավասար է վերջնանյութերի ստանդարտ էներգիաների գումարից հանած ելանյութերի ստանդարտ էներգիաների գումարը![]() Աղյուսակ 1.2-ում
բերված է որոշ նյութերի համար
Աղյուսակ 1.2-ում
բերված է որոշ նյութերի համար
![]() մեծությունները:
մեծությունները:
Օգտագործելով
Գիբսի
գոյացման
ստանդարտ էներգիան
![]() կարելի է
հաշվել տվյալ
ռեակցիայի
Գիբսի էներգիայի
փոփոխությունը
`
կարելի է
հաշվել տվյալ
ռեակցիայի
Գիբսի էներգիայի
փոփոխությունը
` ![]()
Օրինակ 1.7. Հաշվել CO(գ) + H2O(գ) = CO2(գ) + H2(գ) ռեակցիայի Գիբսի էներգիայի փոփոխությունը, եթե հայտնի է, որ
![]()
Լուծում.
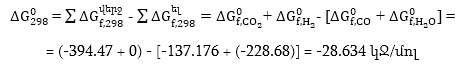
Ստացված
արտահայտությունը
նշանակում է,
որ մեկ CO-ն ու
մեկ մոլ H2O
փոխազդել են և
Գիբսի
էներգիան
նվազել է ![]() Գիբսի
ստանդարտ
էներգիայի կիրառման
դեպքում ոչ
ստացիոնար
պայմաններում
պրոցեսի
ընթանալու
չափանիշը
պետք է ընդունել
∆G0 << 0 պայմանը,
իսկ պրոցեսի
սկզբունքային
անհնարինության
պայմանը ∆G0 >>
0 –ն է:
Գիբսի
ստանդարտ
էներգիայի կիրառման
դեպքում ոչ
ստացիոնար
պայմաններում
պրոցեսի
ընթանալու
չափանիշը
պետք է ընդունել
∆G0 << 0 պայմանը,
իսկ պրոցեսի
սկզբունքային
անհնարինության
պայմանը ∆G0 >>
0 –ն է:
2. ՔԻՄԻԱԿԱՆ ԿԻՆԵՏԻԿԱ ԵՎ ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅՈՒՆ
![]() 2.1.ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅՈՒՆ
2.1.ՔԻՄԻԱԿԱՆ ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅՈՒՆ
Քիմիայի այն բաժինը, որն ուսումնասիրում է ռեակցիայի արագությունը և նրա վրա ազդող գործոնները, կոչվում է քիմիական կինետիկա:
Ռեակցիայի արագությունը քննարկելիս անհրաժեշտ է տարբերել ռեակցիաները, որոնք ընթանում են համասեռ (հոմոգեն) և անհամասեռ (հետերոգեն) համակարգերում:
Համասեռ կոչվում են այն համակարգերը, որոնք կազմված են մեկ ֆազից (հեղուկ կամ գազային): Անհամասեռ (հետերոգեն) կոչվում են այն համակարգերը, որոնք կազմված են մի քանի ֆազերից:
Ֆազը համակարգի մասն է, որի բոլոր կետերում նույն ֆիզիկա-քիմիական հատկություններն են, որը բաժանված է մնացած մասերից բաժանման մակերևույթով և որի միջոցով անցնելիս հատկությունները թռիչքաձև փոխվում են:
Գոյություն ունի երեք ագրեգատային վիճակ` պինդ, հեղուկ և գազային: Համասեռ համակարգի օրինակ է ազոտի և թթվածնի խառնուրդը: Այլ օրինակ է նատրիումի քլորիդի ջրային լուծույթը, ազոտի և թթվածնի լուծույթը ջրում: Այս երկու դեպքերում էլ համակարգը կազմված է մի ֆազից` գազային ֆազից առաջին դեպքում և հեղուկ ֆազից` երկրորդ դեպքում:
Համասեռ համակարգում ընթացող ռեակցիայի օրինակ է մեթանի այրումը
![]()
Անհամասեռ համակարգ է, օրինակ ջուրը, որի մեջ կան սառույցի կտորներ: Համակարգը կազմված է մեկ նյութից, բայց երկու ֆազից:
Անհամասեռ ռեակցիան ընթանում է ֆազերի բաժանման սահմանում:
![]()
Ցանկացած պրոցեսի արագություն կոչվում է այդ պրոցեսում կատարվող փոփոխությունները միավոր ժամանակում: Ռեակցիայի ընթացքում փոխվում են մասնակցող նյութերի քանակները, ուստի համասեռ ռեակցիայի արագությունը ռեակցիայի մեջ մտնող կամ ռեակցիայի հետևանքով ստացվող նյութերից մեկի մոլերի թվի փոփոխությունն է միավոր ժամանակում, համակարգի միավոր ծավալում:
![]()

Մոլերի թվի և (v) ծավալի հարաբերությունը (V) իրենից կոնցենտրացիան է (C) C = v / V կամ ΔC = Δv / V, որտեղից կստանանք.
![]()
Պետք է հիշել, որ ելանյութերի կոնցենտրացիան նվազում է (dC < 0), իսկ վերջնանյութի կոնցենտրացիան աճում է (dC > 0): Այդ պատճառով ելանյութերի համար այդ ածանցյալը փոքր է զրոյից (dC < 0, dt > 0), իսկ վերջանյութի համար մեծ է զրոյից (dC > 0, dt > 0):
![]() Այսպիսով, համասեռ ռեակցիայի արագությունը ելանյութերից կամ վերջանյութերից մեկի կոնցենտրացիայի ածանցյալն է ըստ ժամանակի:
Այսպիսով, համասեռ ռեակցիայի արագությունը ելանյութերից կամ վերջանյութերից մեկի կոնցենտրացիայի ածանցյալն է ըստ ժամանակի:
Անհամասեռ ռեակցիայի արագությանը ելանյութերից կամ վերջանյութերից մեկի մոլերի թվի փոփոխությունն է միավոր մակերեսի վրա, միավոր ժամանակում:
![]()
Որտեղ S-ը ֆազերի բաժանման մակերեսն է:
Քիմիական ռեակցիաները բաժանվում են տարրական (միափուլ) և բարդ (բազմափուլ) ռեակցիաների:
Տարրական ռեակցիայի դեպքում, համակարգում ընթանում է միապրոցես և ռեակցիայի հավասարումը բացահայտում է նրա մեխանիզմը: Ռեակցիաների մեծ մասը բարդ են և իրենցից ներկայացնում են միա շարք տարրական ռեակցիաների գումար: Բարդ ռեակցիաների սովորական գրառումը, որպես կանոն չի արտացոլում իրական մեխանիզմը: Ռեակցիայի փուլերը կարող են լինել ինչպես քիմիական ռեակցիաները, այնպես էլ, օրինակ, գազ ֆազից անցումը մակերևույթի վրա:
Ռեակցիայի արագությունը կախված է բազմաթիվ գործոններից: Ռեակցիայի արագության վրա ազդող գործոններից առավել կարևորներն են կոնցենտրացիան, ճնշումը, ջերմաստիճանը, կատալիզատորի ներկայությունը:
2.2.ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅԱՆ ԿԱԽՈՒՄԸ ՌԵԱԿՑՈՂ ՆՅՈՒԹԵՐԻ ԿՈՆՑԵՆՏՐԱՑԻԱՅԻՑ
Ռեակցիան ընթանալու համար անհարժեշտ է, որ ռեակցող մոլեկուլները բախվեն իրար, ավելի ճիշտ մասնիկներն այնքան մոտենան իրար, որ նյութերից մեկի մոլեկուլի մեջ մտնող ատոմները փոխազդեն մյուս նյութի մոլեկուլի ատոմների հետ: Այդ պատճառով ռեակցիայի արագությունը համեմատական է ռեակցող մոլեկուլների բախումների թվին: Իր հերթին, ռեակցող մոլեկուլների բախումների թիվը համեմատական է յուրաքանչյուր բախվող նյութի կոնցենտրացիային: Ընդհանուր դեպքում, եթե ունենք A + B = AB ռեակցիան, ապա
![]()
Որտեղ [A] և [B] -ն այդ նյութերի կոնցենտրացիան են:
![]() K-ն համեմատականության գործակիցն է և կոչվում է արագության հաստատուն: Հավասարումից երևում է, որ եթե [A] = [B] = 1մոլ/լ, ապա v = k: Այսինքն`
K-ն համեմատականության գործակիցն է և կոչվում է արագության հաստատուն: Հավասարումից երևում է, որ եթե [A] = [B] = 1մոլ/լ, ապա v = k: Այսինքն`
արագության հաստատունը հավասար է ռեակցիայի արագությանը, երբ փոխազդող նյութերի կանցենտրացիաները հավասար են մեկի:
Տվյալ ռեակցիայի արագության հաստատունն ավելի բնութագրական մեծություն է ռեակցիայի համար, քան արագությունը, որովհետև k-ն կախված չէ կոնցենտրացիաներից և տվյալ ջերմաստիճանը կախված է ռեակցող նյութերի բնույթից, այսինքն ռեակցիայի տեսակից:
![]() Հեշտ է ցույց տալ, որ եթե քիմիական հավասարումը ունի գործակիցներ, արագության արտահայտության մեջ համապատասխան նյութերի կոնցենտրացիաների վրա դառնում են աստիճանացույցեր:
Հեշտ է ցույց տալ, որ եթե քիմիական հավասարումը ունի գործակիցներ, արագության արտահայտության մեջ համապատասխան նյութերի կոնցենտրացիաների վրա դառնում են աստիճանացույցեր:
Համասեռ (հոմոգեն) տարրական ռեակցիայի արագությունը ուղիղ համեմատական է ռեակցիայի մեջ մտնող նյութերի կոնցենտրացիաների արտադրյալին, ընդ որում հավասարման գործակիցները գրվում են կոնցենտրացիաների աստիճանացույցում (զանգվածների ազդման օրենք):
Օրինակ.
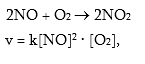
որտեղ`
[NO]- NO-ի կոնցենտրացիան է [մոլ/լ],
[O2]- O2-ի կոնցենտրացիան [մոլ/լ],
K-ն կոչվում է արագության հաստատուն: K-ն կախված չէ կոնցենտրացիայից, սակայն կախված է
1)ռեակցող նյութի բնույթից,
2)ջերմաստիճանից,
3)կատալիզատորի ներկայությունից:
Բերված (2.4) հավասարումը ռեակցիայի արագության արտահայտությունն է և արտացոլում է զանգվածների ազդման օրենքը, իսկ հավասարումը կոչվում է կինետիկ հավասարում:
Անհամասեռ ռեակցիաների դեպքում ռեակցիայի արագության արտահայտության մեջ մտնում են միայն այն նյութերը, որոնք գտնվում են գազ ֆազում կան լուծույթում:
![]()
Ածխածնի կոնցենտրացիան հաստատուն մեծություն է [C] = const: Արագության արտահայտությունը կլինի.
![]()
2.3.ՌԵԱԿՑԻԱՅԻ ՄՈԼԵԿՈՒԼԱՅՆՈՒԹՅՈՒՆԸ ԵՎ ԿԱՐԳԸ
Քիմիական ռեակցիայի տարրական ակտին մասնակցող մոլեկուլների թիվը կոչվում է ռեակցիայի մոլեկուլայնություն:
Ըստ ռեակցիային մասնակցող մոլեկուլների թվի ռեակցիաները լինում են մոնոմոլեկուլային (միամոլեկուլային), բիմոլեկուլային (երկմոլեկուլային) և այլն: Շատ թվով մոլեկուլների միաժամակյա բախումը քիչ հավանական է. այսպես բացառիկ են եռմոլեկուլային ռեակցիները, իսկ քառամոլեկուլ ռեակցիա չկա:
Կինետիկական հավասարման մեջ մտնող կոնցենտրացիաների աստիճանացույցերի գումարը կոչվում է ռեակցիայի ընդհանուր կարգ:
Առանձին նյութի կոնցենտրացիայի աստիճանացույցը կոչվում է ռեակցիայի կարգ ըստ այդ նյութի:
Օրինակ`
![]()
Նշված ռեակցիայի կարգը հավասար է երեքի, ըստ ազոտի օքսիդի ռեակցիայի կարգը հավասար է երկուսի:
Բազմաթիվ դեպքերում, երբ պրոցեսը բազմափուլ է, ռեակցիայի կարգը չի համընկնում մոլեկուլայնության հետ, օրինակ`
![]()
Նշված ռեակցիան ոչ թե երկրորդ կարգի է, այլ առաջին կարգի: Իրականում ռեակցիան ընթանում է երկու փուլով:
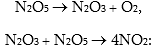
Առաջին փուլի արագությունը զգալի փոքր է երկրորդ փուլի արագությունից, որը և որոշում է ռեակցիայի կարգը:
2.4.ՌԵԱԿՑԻԱՅԻ ԱՐԱԳՈՒԹՅԱՆ ԿԱԽՈՒՄԸ ՋԵՐՄԱՍՏԻՃԱՆԻՑ
Ջերմաստիճանի բարձրացումից մեծանում է մոլեկուլի կինետիկ էներգիան, ուստի շարժման արագությունը: Դրա հետևանքով կմեծանա դրանց միջև բախումների թիվը, հետևաբար և ռեակցիայի արագությունը: Նշանակում է ռեակցիայի արագությունը ջերմաստիճանից ևս պետք է կախված լինի ուղիղ համեմատականությամբ: Փորձը ցույց է տալիս, որ ջերմաստիճանը յուրաքանչյուր տասն աստիճանով մեծացնելիս համասեռ ռեակցիայի արագությունը մեծանում է 2-4 անգամ: Այդ մեծությունը կոչվում է ռեակցիայի արագության ջերմաստիճանային գործակից:
![]()
Վանտ-Հոֆի կանոնն է, եթե ընդունենք, որ ռեակցիայի γ = 2, ապա`

Այսպիսով, ջերմաստիճանը 1000-ով բարձրացնելիս ռեակցիայի արագությունը մեծանում է 1024 անգամ: Վանտ-
Հոֆի կանոնը կարելի է արտահայտել հետևյալ առնչութամբ:
![]()
![]()
Ռեակցիայի արագության մեծացումը բացատրել ենք մոլեկուլների բախումների թվի մեծացումով: Հաշվենք, թե ջերմաստիճանը 100C-ով բարձրացնելիս քանի անգամ կմեծանա բախումների թիվը:
Մոլեկուլների կինետիկական էներգիան որոշվում է հետևյալ երկու հավասարումներով:
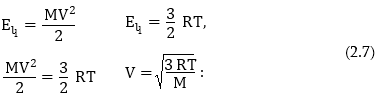
Ուստի եթե ջերմաստիճանը բարձրացվի 300 K–ից 400 K–ի բախումների թիվը կաճի.
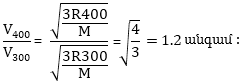
Այսպիսով, ջերմաստիճանը 1000C-ով բարձրացնելիս մոլեկուլների շարժման արագությունը մեծանում է ընդամենը 1.2 անգամ, մինչդեռ ռեակցիայի արագությունը մեծանում է մոտ 1000 անգամ: Հետևաբար բախումների թվի աճը արագությամ մեծացման հիմնական պատճառը չէ, կա այլ ավելի կարևոր պատճառ:
Մոլեկուլների ոչ բոլոր բախումներն են ավարտվում ռեակցիայով: Ռեակցիոնունակ են միայն այն մոլեկուլները, որոնց էներգիան մեծ է որոշակի սահմանային էներգիայից: Այդ էներգիան անվանենք ակտիվ մոլեկուլներ:
![]() Ակտիվացման
էներգիան
այն նվազագույն
ավելցուկային
էներգիան
է, որ պետք է ունենա մոլեկուլը,
որպեսզի
նրա բախումն
ավարտվի
քիմիական
ռեակցիայով:
Ակտիվացման
էներգիան
այն նվազագույն
ավելցուկային
էներգիան
է, որ պետք է ունենա մոլեկուլը,
որպեսզի
նրա բախումն
ավարտվի
քիմիական
ռեակցիայով:
Ջերմաստիճանը մեծացնելիս մոլեկուլների բախումների թիվը քիչ է փոխվում, սակայն ակտիվ մոլեկուլների թիվը խիստ մեծանում է:
Ֆիզիկայից հայտնի է, որ գազի մոլեկուլներն ունեն որոշակի բաշխում ըստ էներգիայի, որը նկարագրվում է Մաքսվելի օրենքով: Որպես օրինակ Նկ.(2.1)-ում բերված է գազի մոլեկուլների այդպիսի բաշխումը հաստատուն ջերմաստիճանի դեպքում: Հորիզոնական առանցքի ուղղությամբ նշված է գազի մեկ մոլեկուլի E էներգիան: Ուղղաձիգ առանցքի վրա մոլեկուլների ընդհանուր թվի այն մասը, որի էներգիան ընկած է E-ից մինչև E + ΔE: Եթե մոլեկուլների ընդհանուր թիվը նշանակենք N-ով, իսկ նշված բնութագիր ունեցող մասը ΔN / N-ով, ապա օրդինատների վրա տեղադրված մեծությունը կլինի ΔN / NΔE:
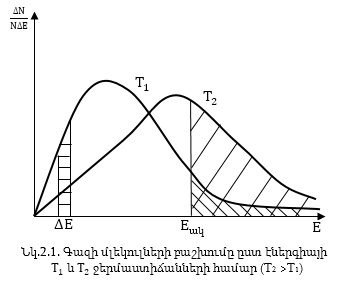
Նկ. 2.1-ում հորիզոնական շտրիխված սյան մակերեսը հավասար կլինի
![]()
այսինքն մոլեկուլների այն մասին որբ ունի էներգիա ΔE միջակայքում: Այդ դեպքում կորով և աբցիսների առանցքուվ պարփակված մակերեսը հավասար կլինի մեկի, այսինքն համեմատական կլինի մոլկուլների ընդհանուր թվին, նկարից երևում է, որ մոլեկուլների քիչ մասը ունի փոքր էներգիա, դարձյալ քիչ մասը` մեծ էներգիա, իսկ մեծ մասն ունի միջին էներգիա: Նկարից երևում է, որ եթե ակտիվացման էներգիան (Eակ) մեծ է, ապա T1 ջերմաստիճանում մոլեկուլների մեծ մասը կլինի ակտիվ:
Ջերմաստիճանը բարձրացնելիս բոլոր մոլեկուլները ստանում են էներգիա, ուստի կորը տեղաշարժվում է դեպի աջ (Նկ.2.1.) փոքր և միջին էներգիա ունեցող մոլեկուլների հաշվին մեծանում է մեծ էներգիա ունեցող ակտիվ մոլեկուլների թիվը, այդ պատճառով ռեակցիայի արագությունը խիստ մեծանում է:
Ռեակցիայի արագության վրա ջերմաստիճանի ազդեցության քանակական օրինաչափությունն արտահայտվում է Արենիուսի բանաձևով
![]()

Հաճախ այդ հավասարումը գրվում է լոգարիթմական տեսքով.
![]()
Առաջին հայացքից կարող է թվալ, թե
![]()
արտահայտությունը բարդ կախում է ընկալման համար: Սակայն եթե հիշենք, որ
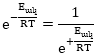 ,
,
ապա դժվար չէ հասկանալ, որ այն մոլեկուլների բաժինն է , որոնք ունեն Eակ-ից մեծ էներգիա, և դրանք կարող են ռեակցիայի մեջ մտնել: Որքան մեծ է ակտիվացման էներգիան` Eակ-ն այնքան փոքր է ռեակցիայի արագությունը: Եթե ակտիվացման էներգիան մնում է հաստատուն, իսկ ջերմաստիճանը բարձրացվում է, ապա նշված մոլեկուլների բաժինը, որն արտահայտվում է
![]()
արտահայտությամբ, մեծանում է:
Քանի որ քիմիական ռեակցիայի ժամանակ տեղի է ունենում որոշ կապերի խզում և նոր կապերի առաջացում, ապա կարելի է մտածել, որ ակտիվացման էներգիան հավասար է քիմիական կապի խզման էներգիային: Սակայն ակտիվացման էներգիայի չափումը ցույց է տալիս, որ այն միշտ փոքր է կապի էներգիայից: Քիմիական ռեակցիան իրականացնելու համար անհրաժեշտ չէ քիմիական կապի լրիվ խզումը մոլեկուլում, անհրաժեշտ է միայն որ կապը թուլանա:
Այնպիսի անկայուն միջանկյալ վիճակը, երբ հին կապերը լրիվ չեն խզվում, իսկ նոր կապերը լրիվ չեն առաջացել, կոչվում է ակտիվ կոմպլեքսի վիճակ: Ակտիվ կոմպլեքսի էներգիայի և ելանյութերի միջին էներգիայի տարբերությունը հենց ակտիվացման էներգիան է: Ակտիվ կոմպլեքսի, այսինքն միջանկյալ վիճակի առաջացումը էներգետիկ տեսակետից ավելի ձեռնտու է, քան մոլեկուլի լրիվ քայքայումը: Պրոցեսների մեծ մասի համար ակտիվացման էներգիան բավականին փոքր է ելանյութի մոլեկուլի ամենաթույլ կապի էներգիայից:
Ուղիղ ![]() և
հակադարձ
և
հակադարձ![]() ռեակցիաների
ակտիվացման
էներգիաների
տարբերությունը
հավասար է
ռեակցիայի ջերմային
էֆեկտին:
ռեակցիաների
ակտիվացման
էներգիաների
տարբերությունը
հավասար է
ռեակցիայի ջերմային
էֆեկտին:
![]()
Եթե
ΔH > 0
(ջերմակլանիչ
պրոցես), ապա ![]() այսինքն
այսինքն
![]() եթե ΔH < 0
(ջերմանջատիչ
պրոցես),
եթե ΔH < 0
(ջերմանջատիչ
պրոցես),![]() այսինքն
այսինքն
![]() : Նկար
2.2-ում, որպես
օրինակ
բերված է
մեթանի և քլոր
իոնի
ռեակցիայի սխեման:
: Նկար
2.2-ում, որպես
օրինակ
բերված է
մեթանի և քլոր
իոնի
ռեակցիայի սխեման:
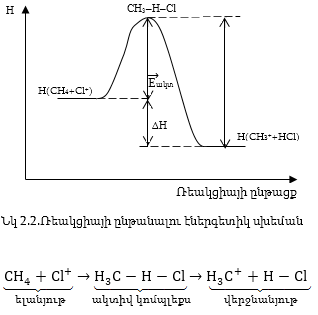
2.5.ԿԱՏԱԼԻԶ: ՀԻՄՆԱԿԱՆ ՀԱՍԿԱՑՈՒԹՅՈՒՆՆԵՐ
Այն նյութերը, որոնք մասնակցելով ռեակցիային փոխում են դրա արագությունը մնալով անփոփոխ բաղադրությամբ և քանակով, կոչվում են կատալիզատորներ:
Կատալիզատորի ներկայությամբ ընթացող ռեակցիաներըկոչվում են կատալիտիկ ռեակցիաներ, իսկ ռեակցիայի արագության մեծացումը կատալիզատորների ազդեցության տակ կոչվում է կատալիզ: Հայտնի են դեպքեր, երբ կատալիզատոր է հանդիսանում ռեակցիայի վերջնանյութերից մեկը: Այս երևույթը կոչվում է ինքնակատալիզ:
Կատալիզը կարող է լինել համասեռ(հոմոգեն), երբ ռեակցող նյութերը և կատալիզատորը գտնվում են նույն ֆազում և անհամասեռ(հետերոգեն), երբ կատալիզատորը և ռեակցող նյութերը գտնվում են տարբեր ֆազերում: Հետերոգեն կատալիզի դեպքում ռեակցիայի արագացումը կապված է պինդ մարմնի մակերևույթի կատալիտիկ ազդեցությամբ: Անհամասեռ կատալիզի դեպքում որպես կատալիզատոր օգտագործում են անցումային մետաղները, դրանց օքսիդները կամ այլ միացություններ: Կատալիզատորները տարբերակվում են ընտրողականությամբ: Այսպես, 350-300 0C ջերմաստիճանում ալյումինիումի օքսիդի վրա ընթանում է էթանոլի դեհիդրատացիան,
![]()
իսկ 200-250 0C-ում, պղնձի վրա ընթանում է դիհիդրումը.
![]()
Կատալիզատորի բացակայությամբ այդ երկու ռեակցիաները ընթանում են զուգահեռ: Կատալիզատորի ակտիվությունը մեծացնող նյութերը, որոնք ինքնուրույն կատալիզատոր չեն, կոչվում են պրոմատորներ: Կատալիզատորի ակտիվությունը նվազեցնող նյութերը կոչվում են կատալիտիկ թույներ:
2.6. ԿԱՏԱԼԻԶԻ ՏԵՍՈՒԹՅԱՆ ՏԱՐՐԵՐԸ
Բոլոր
դեպքերում
կատալիզատորը
փոքրացնում է
ռեակցիայի
ակտիվացման
էներգիան:
Ակտիվացման էներգիայի
փոքրացումը ![]() այնքան
ավելի մեծ է,
որքան ակտիվ
է կատալիզատորը:
Այսպես, օրինակ,
այնքան
ավելի մեծ է,
որքան ակտիվ
է կատալիզատորը:
Այսպես, օրինակ,
![]() ռեակցիայի
ակտիվացման էներգիան
փոքրանում է
ոսկու (Au)
ներկայությամբ
184-ից մինչև 105կՋ,
իսկ պլատինի
ներկայությամբ`
մինչև 69 կՋ:
ռեակցիայի
ակտիվացման էներգիան
փոքրանում է
ոսկու (Au)
ներկայությամբ
184-ից մինչև 105կՋ,
իսկ պլատինի
ներկայությամբ`
մինչև 69 կՋ:
Գոյություն ունի կատալիզի երկու տեսություն:
1.Կատալիզի միջանկյալ միացությունների տեսություն: Ըստ այդ տեսության հոմոգեն ռեակցիաներում կատալիզատորը ելանյութերից մեկի հետ առաջացնում է միջանկյալ միացություն: Ռեակցիան ընթանում է նոր փուլերով, որոնք ունեն ավելի փոքր ակտիվացման էներգիա, քան առանց կատալիզատորի ռեակցիան, ուստի ընթանում են ավելի արագ: Միջանկյալ միացությունը փոխազդում է մյուս ելանյութի հետ` առաջացնելով վերջանյութ: Քննարկենք ծծմբային գազից ծծմբական գազի ստացման ռեակցիան: Այդ ռեակցիան առանց կատալիզատորի ընթանում է դանդաղ հետևյալ կերպ.
![]()
NO2 կատալիզատորի ներկայությամբ ռեակցիան ընթանում է երկու արագ փուլերով:
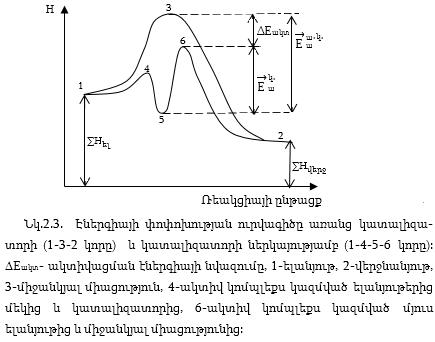
Բոլոր դեպքերում պահպանվում է ΔG<0 պայմանը:
Նկ.2.3-ում ցույց է տրված ռեակցիայի էներգիայի փոփոխության ուրվագիծը առանց կատալիզատորի և կատալիզատորի ներկայությամբ:
Որքան մեծ կատալիզատորի ներկայությամբ ակտիվացման էներգիայի նվազումը ΔEակտ, այնքան ավելի ակտիվ է կատալիզատորը:
2.Կատալիզի ադսորբցիոն տեսություն:
Ադսորբցիան գազի կամ հեղուկի կլանումն է պինդ նյութի մակերևույթի կողմից: Օրինակ, հակագազերում թունավոր գազերը կլանելու համար օգտագործվում է ակտիվացրած ածուխ: Լավ ադսորբենտներ են նաև Հայաստանում լայնորեն տարածված ցեոլիտները, որոնք տաքացնելիս ջրազրկվում են, առաջանում են դատարկ խոռոչներ, որտեղ և կլանվում են ադսորբվող գազերը կամ հեղուկները:
Ռեակցող նյութերը ադսորբվում են կատալիզատորի մակերևույթի վրա, դրանց կոնցենտրացիան մեծանում է, և ռեակցիան արագանում է: Օրինակ V2O5-ը արագացնում է SO2-ի և O2-ի ռեակցիան:
![]()
Գոյություն ունեն նյութեր, որոնք փոքրացնում են ռեակցիայի արագությունը: Օրինակ Pb(C2H5)4-ը` տետրաէթիլ կապարը դանդաղեցնում է բենզինի այրման ռեակցիան, այդ պատճառով այն ավելացնում են բենզինի մեջ, որպեսզի չինքնաբոցավառվի:
Մարդու օրգանիզմում, բոլոր պրոցեսներն ընթանում են 36-ից 370C ջերմաստիճանում: Այդ պրոցեսներն ընթանում են կենսաբանական կատալիզատորների ներկայությամբ, որոնք կոչվում են ֆերմենտներ: Դրանք պարզ կամ բարդ սպիտակուցներ են: Այսպես, թուքը պարունակում է պտիալին ֆերմենտը, որն արագացնում է` կատալիզում է շաքարի փոխարկումը օսլայի: Օրգանիզմում ֆերմենտների ներկայությամբ շաքարի փոխարկումը օսլայի 106 անգամ արագ է ընթացնում, քան նույն ջերմաստիճանում ջրային լուծույթում: Ստամոքսում եղած պեպսին ֆերմենտը արագանում է սպիտակուցների ճեղքումը: Մարդու օրգանիզմում կան մոտ 30000 տարբեր ֆերմենտներ, որոնցից յուրաքանչյուրը համապատասխան ռեակցիայի կատալիզատոր է:
2.7.ՇՂԹԱՅԱԿԱՆ ՌԵԱԿՑԻԱՆԵՐ
Ազատ ռադիկալային ռեակցիաները սովորաբար ընթանում են շղթայական մեխանիզմով: Ազատ ռադիկալների առաջացումը հնարավորություն է տալիս ոչ ակտիվ մոլեկուլներին դառնալ ակտիվ: Շղթայական ռեակցիաների տեսությունը ստեղծվել է Ն. Ն. Սեմյոնովի (Ռուսաստան) և Խինշելվուդի (Անգլիա) կողմից, որոնք դրան համար ստացել են Նոբելյան մրցանակ:
Գոյություն ունի շղթայական ռեակցիաների երկու տեսակ` չճյուղավորված և ճյուղավորված:
1. Չճյուղավորված շղթայական ռեակցիաներ:
Չճյուղավորված շղթայական ռեակցիայի օրինակ է քլորաջրածնի ֆոտոքիմիական սինթեզը:
Լույսի քվանտի ազդեցության տակ քլորի մոլեկուլը տրոհվում է քլորի ազատ ռադիկալների` ազատ ատոմների:
![]()
Այս ռեակցիան կոչվում է շղթայի ծնունդ: Cl* ազատ ռադիկալը փոխազդում է H2 մոլեկուլի հետ` առաջացնելով HCl մոլեկուլ և H* ատոմ-ռադիկալ:
![]()
H* ատոմ-ռադիկալը փոխազդում է Cl2 մոլեկուլի հետ` առաջացնելով HCl մոլեկուլ և Cl* ատոմ-ռադիկալ: Այս պրոցեսը շարունակվում է և կոչվում է ռեակցիայի շարունակում:

Շղթայի շարունակման տարրական ռեակցիաների թիվը հասնում է հարյուր հազարների:
Այլ կերպ ասած, կլանված մեկ լուսային քվանտը հանգեցնում է հարյուր հազար մոլեկուլ HCl-ի առաջացմանը:
Շղթայի խզումը տեղի է ունենում ռադիկալների ռեկոմբինացիայի շնորհիվ
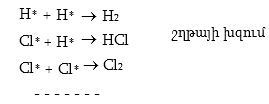
Սակայն դա տեղի ունենում միայն այն դեպքում, երբ անջատվող էներգիան կլանվում է երրորդ մարմնի կողմից, օրինակ երկու ռադիկալների և երրորդ մոլեկուլի եռակի հարվածի դեպքում:
![]()
Երրորդ մարմնի դերը կարող է խաղալ նաև անոթի պատը:
2. Ճյուղավորված շղթայական ռեակցիաներ: Ճյուղավորված շղթայական ռեակցիայի օրինակ է ջրածնից և թթվածնից ջրի առաջացումը:
Ջրածնի և թթվածնի խառնուրդը տաքացնելիս կամ նրանում էլեկտրական պարպում բաց թողնելիս H2 և O2-ի միջև ընթանում է ռեակցիա.
![]()
OH* ռադիկալը փոխազդում է H2 մոլեկուլի հետ` առաջացնելով H2O և H* ռադիկալ:
![]()
Ճյուղավորված շղթայական ռեակցիաները տարբերվում են չճյուղավորված ռեակցիաներից նրանով, որ ազատ ռադիկալը մոլեկուլի հետ փոխազդելիս առաջացնում է ոչ թե մեկ, այլ երկու և ավելի ազատ ռադիկալներ:
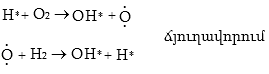
Դրանցից մեկը շարունակում է հին շղթան, իսկ մյուսները նորերի սկիզբ են դնում, շղթան ճյուղավորվում է, և ռեակցիան պրոգրեսիվ կերպով արագանում է: Ռադիկալների բազմացումը բերում է ռեակցիայի արագության կտրուկ աճին, որը կարող է վերջանալ պայթյունով: Այս դեպքում ևս տեղի ունի շղթայի խզում:
Շղթայական մեխանիզմով են ընթանում այնպիսի կարևոր ռեակցիաներ` ինչպես այրումը, պայթյունը, ածխաջրածինների օքսիդացումը և պոլիմերացման ռեակցիաները: Այդ պատճառով շղթայական ռեակցիաների տեսությունը գիտական հիմք է ծառայում տեխնիկայի և քիմիական տեխնոլոգիայի մի շարք կարևոր բնագավառների համար:
2.8. ՔԻՄԻԱԿԱՆ ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅՈՒՆ
Դարձելի և ոչ դարձելի ռեակցիաներ: Շատ քիմիական ռեակցիաներ ընթանում են մինչև վերջ, այսինքն ելանյութերը ամբողջությամբ վեր են ածվում վերջնանյութերի: Այդպիսի ռեակցիաները կոչվում են ոչ դարձելի: Օրինակ, ցինկի և աղաթթվի միջև ընթացող ռեակցիան` Zn + 2HCl = ZnCl2 + H2 ոչ դարձելի է, որովհետև ռեակցիան ընթանում է այնքան ժամանակ մինչև որ ելանյութը` ցինկը կամ աղաթթուն սպառվեն և հակառակ ռեակցիան, որ ջրածինը փոխազդի ցինկի քլորիդի հետ առաջացնելով մետաղական ցինկ, տեղի չի ունենում:
Դարձելի
կոչվում են
այն
ռեակցիաները,
որոնք միչև
վերջ չեն
ընթանում,
քանի որ
վերջնանյութերը
այդ նույն
պայմաններում
կարող են
փոխազդել իրար
հետ և
առաջացնել
ելանյութեր:
Օրինակ` ջրածինը
փոխազդում է
յոդի հետ`
առաջացնելով
յոդաջրածին,
սակայն այդ
նույն
պայմաններում
յոդաջրածինը
կարող է
քայքայվել`
վերածվելով
ջրածնի և յոդի:
Այդ պատճառով
դարձելի
ռեակցիաների
հավասարումներում
հավասարման
նշանի փոխարեն
դրվում են
երկու
սլաքներ`
հակառակ
ուղղություններով` ![]() :
:
Ձախից աջ գնացող ռեակցիան կոչվում է ուղիղ, իսկ աջից ձախ գնացողը` հակառակ ռեակցիա:
Չնայած տեսականորեն ոչ դարձելի ռեակցիաների համար կարելի է ընտրել պայմաններ, որոնցում նրանք կլինեն դարձելի, սակայն շատ ոչ դարձելի ռեակցիաների համար դա հնարավոր չէ:
Քննարկենք, թե ինչ վիճակի են հասնում դարձելի ռեակցիաները սկսվելուց որոշ ժամանակ հետո: Ենթադրենք ունենք միջնապատով բաժանված անոթ, որի մի մասում լցված է ջրածին, մյուս մասում` յոդ և միջնապատը հանենք: Սկզբում կընթանա միայն ուղիղ ռեակցիան` ![]()
նրա
արագությունը
![]() սկզբում
կունենա
ինչ-որ
առավելագույն
արժեք և ժամանակի
ընթացքում
կնվազի, որովհետև
այդ
ռեակցիայի
ընթացման
հետևանքով
ջրածնի և յոդի
կոնցենտրացիաները
կնվազեն(ՆԿ.):
Հակառակ
ռեակցիան
սկզբում
կունենա
ինչ-որ
առավելագույն
արժեք և ժամանակի
ընթացքում
կնվազի, որովհետև
այդ
ռեակցիայի
ընթացման
հետևանքով
ջրածնի և յոդի
կոնցենտրացիաները
կնվազեն(ՆԿ.):
Հակառակ
ռեակցիան ![]() սկզբում
տեղի չի
ունենա, նրա
սկզբում
տեղի չի
ունենա, նրա![]() արագությունը
արագությունը
![]() կլինի զրո,
որովհետև
յոդաջրածին
չկա: Սակայն
ուղիղ
ռեակցիայի
ընթացման հետևանքով
յոդաջրածնի
կոնցենտրացիան
կսկսի
մեծանալ
կլինի զրո,
որովհետև
յոդաջրածին
չկա: Սակայն
ուղիղ
ռեակցիայի
ընթացման հետևանքով
յոդաջրածնի
կոնցենտրացիան
կսկսի
մեծանալ![]() կմեծանա: Որոշ
ժամանակ հետո
կմեծանա: Որոշ
ժամանակ հետո ![]() արագությունները
կհավասարվեն
արագությունները
կհավասարվեն ![]() (Նկ. 2.4):
(Նկ. 2.4):
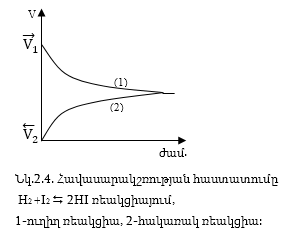
Դա
նշանակում է,
որ միավոր
ժամանակում
որքան ջրածին
և յոդ փոխազդում
են,
առաջացնելով
HI այնքան էլ
առաջանում են
HI-ի
քայքայումից:
Հետևաբար
ջրածնի, յոդի
և HI-ի կոնցենտրացիաները
այլևս չեն փոխվի,
ուստի ![]() ևս
այլևս չեն
փոխվի` կմնան
իրար հավասար:
Այդպիսի
վիճակը
կոչվում է հավասարկշռության
վիճակ:
Այսպիսով,
ռեակցիաները
սկսվելուց
որոշ ժամանակ
հետո հասնում
է քիմիական
հավասարակշռության,
որի պայմանն է
ևս
այլևս չեն
փոխվի` կմնան
իրար հավասար:
Այդպիսի
վիճակը
կոչվում է հավասարկշռության
վիճակ:
Այսպիսով,
ռեակցիաները
սկսվելուց
որոշ ժամանակ
հետո հասնում
է քիմիական
հավասարակշռության,
որի պայմանն է
![]()
Այսպիսի հավասարակշռությունը կոչվում է շարժուն, քանի որ կոնցենտրացիաները այլևս չեն փոխվում ոչ թե այն պատճառով, որ ռեակցիան տեղի չի ունենում (անշարժ հավասարակշռություն), այլ այն, որ ընթանում է հակառակ ուղղություններով` հավասար արագությամբ:
Դարձելի ռեակցիաները հավասարակշռության վիճակի կարող են հասնել տարբեր չափով ընթանալուց հետո: Կան ռեակցիաներ, որոնք հասնում են հավասարակշռության, երբ ելանյութերի չնչին մասն է միայն վերածվել վերջնանյութերի, ինչպես և հակառակը, երբ հավասարակշռություն հաստատվում է ելանյութերի մեծ մասի փոխազդեցությունից հետո: Դա քանակապես բնութագրվում է հավասարակշռության հաստատուն մեծությամբ: Եթե (2.11) հավասարման մեջ տեղադրենք արագությունների արժեքները կստանանք
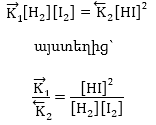
Քանի
որ![]() հաստատուն
են, նրանց
հարաբերությունը
ևս կլինի
հաստատուն:
Նշանակենք
հաստատուն
են, նրանց
հարաբերությունը
ևս կլինի
հաստատուն:
Նշանակենք ![]() Այդ
մեծությունը
կոչվում է
հավասարակշռության
հաստատուն.
Այդ
մեծությունը
կոչվում է
հավասարակշռության
հաստատուն.
![]()
Ընդհանուր դեպքում, եթե ունենք
![]()
Հետևաբար
հավասարակշռության
հաստատունը ցույց
է տալիս
ռեակցիայի
ընթացման
խորությունը:
Եթե K>1
նշանակում է
ուղիղ
ռեակցիան ընթացել
է մեծ չափով
մինչև հավասարակշռության
հասնելը: Եթե
K<<1, ուրեմն
քիչ չափով է
ընթացել,
ռեակցիայի ելքը
փոքր է: Քանի
որ և![]() կոնցենտրացիաներից
կախված չեն,
ապա K-ն ևս
կոնցենտրացիաներից
կախված չպետք
է լինի: Այն
կախված է ռեակցող
նյութերի
ընթացքից և
ջերմաստիճանից:
Որքան մեծ է
Գիբսի
էներգիայի
նվազումը,
այնքան մեծ է
հավասարակշռության
հաստատունը:
կոնցենտրացիաներից
կախված չեն,
ապա K-ն ևս
կոնցենտրացիաներից
կախված չպետք
է լինի: Այն
կախված է ռեակցող
նյութերի
ընթացքից և
ջերմաստիճանից:
Որքան մեծ է
Գիբսի
էներգիայի
նվազումը,
այնքան մեծ է
հավասարակշռության
հաստատունը:
![]()
Այստեղից, ելնելով ΔG–ի արժեքից, կարելի է հաշվել K-ի արժեքը, իսկ դրա միջոցով ըստ (2.12) հավասարման ռեակցիային մասնակցող նյութերի հավասարակշռային կոնցենտրացիաները (2.13) բանաձևից երևում է, որ եթե ΔG0- ն ունի մեծ բացասական արժեք, ապա K-ն կլինի մեծ, այսինքն` հավասարակշռային խառնուրդում ավելի շատ վերջնանյութեր են` ռեակցիան գործնականում ընթանում է մինչև վերջ: Եթե ΔG0>>0 նշանակում է K-ն փոքր է, խառնուրդում ավելի շատ են ելանյութերը` ռեակցիան գործնականում չի ընթանում:
2.9 ՀԱՎԱՍԱՐԱԿՇՌՈՒԹՅԱՆ ՏԵՂԱՇԱՐԺ
Համակարգը (ռեակցիան) կարող է մնալ հավասարակշռության վիճակում այնքան ժամանակ, քանի դեռ չեն փոխվել դրա պայմանները` ճնշումը, ջերմաստիճանը,կոնցենտրացիաները:
Ենթադրենք յոդաջրածնի ստացման անոթի մեջ, ուր ռեակցիան հավասարակշռության վիճակում էր դրսից ջրածին ենք ավելացրել:
Ջրածնի
կոնցենտրացիայի
մեծացումից
ուղիղ ռեակցիայի
![]() արագությունը
կմեծանա
արագությունը
կմեծանա![]() , հակառակ
ռեակցիայի
, հակառակ
ռեակցիայի![]() արագությունը
սկզբում կմնա
նույնը:
արագությունը
սկզբում կմնա
նույնը:
![]() հավասարակշռությունը
կխախտվի (նկ.2.5):
Սակայն ուղիղ
ռեակցիայի
արագ
ընթացման
հետևանքով H2
և I2
կոնցենտրացիաները
կնվազեն,
ուստի
մեծացած
հավասարակշռությունը
կխախտվի (նկ.2.5):
Սակայն ուղիղ
ռեակցիայի
արագ
ընթացման
հետևանքով H2
և I2
կոնցենտրացիաները
կնվազեն,
ուստի
մեծացած ![]() կսկսի
փոքրանալ, իսկ
HI-ի
կոնցենտրացիան`
կաճի, ուստի
կսկսի
փոքրանալ, իսկ
HI-ի
կոնցենտրացիան`
կաճի, ուստի![]() կսկսի
մեծանալ,
մինչև որ որոշ
ժամանակ հետո
դրանք նորից
կհավասարվեն
իրար:
Կհաստատվի նոր
հավասարակշռություն
(նկ. 2.5): Հետևաբար
ջրածնի
կոնցենտրացիայի
մեծացումը առաջացրեց
մնացած I2 և HI
նյութերի
կոնցենտրացիաների
փոփոխություն,
այնպես որ K-ն
մնա նույնը:
կսկսի
մեծանալ,
մինչև որ որոշ
ժամանակ հետո
դրանք նորից
կհավասարվեն
իրար:
Կհաստատվի նոր
հավասարակշռություն
(նկ. 2.5): Հետևաբար
ջրածնի
կոնցենտրացիայի
մեծացումը առաջացրեց
մնացած I2 և HI
նյութերի
կոնցենտրացիաների
փոփոխություն,
այնպես որ K-ն
մնա նույնը:
Այսպիսով, երբ փոխեցինք հավասարակշռության պայմաններից մեկը` ջրածնի կոնցենտրացիան հավասարակշռությունը խախտվեց և ստացվեց ուղիղ ռեակցիա, որը հանգեցրեց ջրածնի մեծացրած կոնցենտրացիայի փոքրացմանը, այսինքն հակազդեց մեր փոփոխությանը: Այս օրինաչափությունը ճիշտ է ոչ միայն կոնցենտրացիայի, այլ նաև ջերմաստիճանի և ճնշման փոփոխության դեպքում և կոչվում է Լե-Շատելյեի սկզբունք:
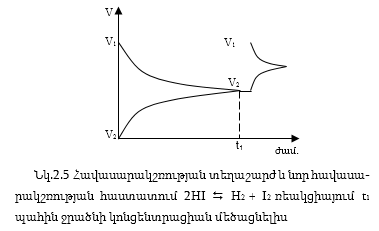
1.Եթե փոխվեն այն պայմաններից որևիցե մեկը, որոնցում համակարգը գտնվում է հավասարակշռության մեջ (ջերմաստիճան, ճնշում, կոնցենտրացիա), ապա հավասարակշռությունը խախտվում է և տեղաշարժվում է այնպիսի ուղղությամբոր հակազդի այդ փոփոխությանը:
Լե-Շատելյեի սկզբունքից հետևում է.
Եթե բարձրացվի հավասարակշռության վիճակում գտնվող համակարգի ջերմաստիճանը, ապա հավասարակշռությունը պետք է տեղաշարժվի այնպիսի ուղղությամբ, բարձրացված ջերմաստիճանը իջնի, իսկ դա տեղի կունենա, եթե արագանա ջերմակլանիչ ռեակցիան, իսկ ջերմաստիճանը իջեցնելիս` ջերմանջատիչ ռեակցիան: Հետևաբար ջերմաստիճանը բարձրացնելիս դարձելի ռեակցիայի հավասարակշռությունը տեղաշարժվում է ջերմակլանիչ, իսկ իջեցնելիս` ջերմանջատիչ ռեակցիաների ուղղությամբ:
Օրինակ. Ամոնիակի սինթեզը դարձելի ռեակցիա է: Ուղիղ ռեակցիան ջերմանջատիչ
![]()
իսկ հակառակը` ջերմակլանիչ: Հետևաբար, ջերմաստիճանի բարձրացումից հավասարակշռությունը կտեղաշարժվի հակառակը, իսկ իջեցումից` ուղիղ ռեակցիայի կողմը:
2.Եթե բարձրացվի հավասարակշռության վիճակում գտնվող գազային համակարգի ճնշումը, ապա ըստ Լե-Շատելյեի սկզբունքի հավասարակշռությունը կխախտվի և կտեղաշարժվի այնպիսի ուղղությամբ, որ ճնշումը փոքրանա: Ճնշումը հետևանք է մոլեկուլների հարվածների, և ուղիղ համեմատական է մոլեկուլների քանակին, ուստի ճնշումը մեծացնելիս դարձելի գազային ռեակցիայի հավասարակշռությունը կտեղաշարժվի փոքր թվով մոլեկուլների առաջացման (ծավալի կրճատման), իսկ փոքրացնելիս` մեծ թվով մոլեկուլների առաջացման (ծավալի մեծացման) կողմը:
Օրինակ. ![]() դարձելի
ռեակցիայում
ուղիղ
ռեակցիայի
ընթացման
հետևանքով
մոլեկուլների
թիվը փոքրանում
է, հետևաբար
ճնշումը
մեծացնելիս
հավասարակշռությունը
կտեղաշարժվի
դեպի ուղիղ, իսկ
փոքրացնելիս
դեպի հակառակ
ռեակցիայի
կողմը:
դարձելի
ռեակցիայում
ուղիղ
ռեակցիայի
ընթացման
հետևանքով
մոլեկուլների
թիվը փոքրանում
է, հետևաբար
ճնշումը
մեծացնելիս
հավասարակշռությունը
կտեղաշարժվի
դեպի ուղիղ, իսկ
փոքրացնելիս
դեպի հակառակ
ռեակցիայի
կողմը:
Օրինակ
2.1 Հաշվել ![]() ռեակցիայում
քանի անգամ
ուղիղ ռեակցիայի
արագության
մեծացումը
մեծ կլինի հակառակ
ռեակցիայի
արագության
մեծացումից,
ճնշումը
երկու անգամ
մեծացնելու
դեպքում:
ռեակցիայում
քանի անգամ
ուղիղ ռեակցիայի
արագության
մեծացումը
մեծ կլինի հակառակ
ռեակցիայի
արագության
մեծացումից,
ճնշումը
երկու անգամ
մեծացնելու
դեպքում:
Լուծում:
Նշանակենք
ուղիղ
ռեակցիայի
արագությունը
![]() իսկ
հակառակ
ռեակցիայինը
իսկ
հակառակ
ռեակցիայինը ![]()
![]()
Ճնշումը երկու անգամ մեծացնելիս կոնցենտրացիաները երկու անգամ կմեծանան, ուստի
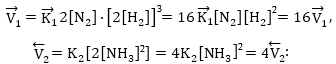
![]()
Ամփոփում
Քիմիական ռեակցիաները ընթանում են էներգիայի, հիմնականում ջերմության, անջատումով կամ կլանումով: Ռեակցիայի ջերմային էֆեկտը հավասար է նրա էնթալպիայի փոփոխությանը: Էնթալպիան համակարգի ներքին էներգիայի և կատարած աշխատանքի գումարն է: Ռեակցիայի ջերմային էֆեկտը կախված չէ նրա ընթացքի փուլերից, այլ կախված է սկզբնական և վերջնական նյութերի տեսակից: Ռեակցիայի ընթացքի ուղղությունը որոշվում է նրա` Գիբսի էներգիայի (G) փոփոխությամբ: Ռեակցիան ինքնաբերաբար ընթանում է, եթե նրա ∆G < 0: Գիբսի էներգիան համակարգի էնթալպիայի և էնտրոպիական գործոնի (TS) տարբերությունն է G = H – TS: Էնտրոպիան վիճակի ֆունկցիա է, որը բնութագրում է համակարգի անկարգավորվածությունը: Ռեակցիայի արագությունը մասնակցող նյութերի կոնցենտրացիայի փոփոխությունն է միավոր ժամանակամիջոցում: Ռեակցիայի արագությունը ուղիղ համեմատական է և մասնակցող նյութերի կոնցենտրացիաներին և ջերմաստիճանին:
Ռեակցիայի արագությունը կախված է նաև կատալիզատորներից` նյութերից, որոնք մասնակցելով ռեակցիային փոփոխում են նրա արագությունը` իրենք մնալով անփոփոխ: Դարձելի կոչվում են այն ռեակցիաները, որոնք մինչև վերջ չեն ընթանում, քանի որ վերջնանյութերը կարող են փոխազդել և առաջացնել ելանյութեր: Դարձելի ռեակցիաները հասնում են հավասարակշռության վիճակի, երբ ուղիղ և հակառակ ռեակցիաների արագությունները հավասարվում են: Եթե փոխվեն հավասարակշռված համակարգի պայմանները, ապա հավասարակշռությունը խախտվում է այնպիսի ուղղությամբ, որ հակազդի այդ փոփոխությանը:
Սովորելու նպատակը
Այս բաժինը սովորելուց հետո դուք պետք է կարողանաք`
1. Հաշվել ռեակցիաների ջերմային էֆեկտները` իմանալով մասնակցող նյութերի գոյացման ջերմությունների մեծությունները:
2. Հաշվել տրված ռեակցիան ինքնաբերաբար կընթանա, թե` ոչ:
3. Հաշվել ռեակցիաների ընթացման արագությունը, նրա կախումը ջերմաստիճանից, կոնցենտրացիաներից:
4. Որոշել դարձելի ռեակցիաների հավասարակշռության տեղաշարժի ուղղությունը, ջերմաստիճանի, կոնցենտրացիաների, ճնշման փոփոխության դեպքում:
1. Ռեակցիաները լինում են ջերմանջատիչ և ջերմակլանիչ:
2. Համակարգի էնթալպիան, նրա ներքին էներգիայի և կատարված աշխատանքի գումարն է H = U+PV:
3. Բարդ նյութի գոյացման ջերմությունը (էնթալպիան) ջերմության այն քանակն է, որը անջատվում կամ կլանվում է, երբ պարզ նյութերից գոյանում է մեկ մոլ բարդ նյութ:
4. Ռեակցիայի ջերմային էֆեկտը կախված չէ նրա ընթացքի փուլերից, այլ կախված է սկզբնական և վերջնական նյութերի տեսակից և վիճակից (Հեսսի օրենք):
5. Ռեակցիայի ջերմային էֆեկտը հավասար է վերջնանյութերի գոյացման ջերմությունների գումարից հանած վերջնայութերի գոյացման ջերմությունների գումարը (հետևություն Հեսսի օրենքից):
6. Ռեակցիան ինքաբերաբար կարող է ընթանալ, եթե նրա Գիբսի էներգիայի փոփոխությունը ΔG փոքր է զրոյից:
7. Գիբսի էներգիայի փոփոխությունը հավասար է էնթալպիայի փոփոխությունը և էնտրոպիական գործոնի տարբերությանը ΔG = ΔH-TΔS:
8. Համակարգի էնթալպիան նրա ներքին էներգիայի և աշխատանքի գումարն է H = U + PV:
9. Համակարգի էնտրոպիան բնորոշում է նրա անկարգավորվածությունը S = KlnW: W-ն համակարգի հնարավոր միկրովիճակների թիվն է:
10. Ռեակցիայի արագություն կոչվում է մասնակցող նյութերի կոնցենտրացիաների փոփոխությունը միավոր ժամանակամիջոցում V= ± ΔC /Δt:
11. Ռեակցիայի արագությունը ուղիղ համեմատական է փոխազդող նյութերի կոնցենտրացիաների արտադրյալին վերցրած այնպիսի ցուցիչներով, ինչպիսի գործակիցներ ունեն հավասարման մեջ (գործող զանգվածների օրենք):
12. Ռեակցիայի արագությունը ջերմաստիճանից կախված է ուղիղ համեմատականորեն: Ակտիվացման էներգիա կոչվում է այն լրացուցիչ էներգիան, որը պետք է հաղորդել մեկ մոլ նյութին` նրա բոլոր մոլեկուլները ակտիվ դարձնելու համար:
13. Կատալիզատորները նյութեր են, որոնք մասնակցելով ռեակցիային` փոխում են նրա արագությունը: Կատալիզատորները ռեակցիան տանում են նոր փուլերով` փոքրացնելով դրանց ակտիվացման էներգիաները:
14. Ռեակցիաները լինում են ոչ դարձելի և դարձելի: Դարձելի կոչվում են այն ռեակցիաները, որոնք մինչև վերջ չեն ընթանում, քանի որ վերջանյութերը փոխազդում են իրար հետ` առաջացնելով ելանյութեր: Դարձելի ռեակցիան հասնում է հավասարակշռության վիճակի, երբ ուղիղ և հակառակ ռեակցիաների արագությունները հավասարվում են:
15. Հավասարակշռության պայմանները փոխելիս հավասարակշռությանը խախտվում է և տեղաշարժվում այնպիսի ուղղությամբ, որ հակազդի այդ փոփոխությանը (Լե-Շատելյեի սկզբունք): Ջերմաստիճանի բարձրացումից հավասարակշռությունը տեղաշարժվում է ջերմակլանիչ, իսկ ճնշման մեծացումից` փոքր թվով մոլեկուլների կողմը: